「エントロピーS = kB log W」→ S = log W 「温度T」→ 温度β = dS/dH ゴムには「熱すると短くなる」という性質がある。 温度βで言い換えると,《ゴムは冷やすと短くなる》。 高分子化合物を構成する分子について,つぎのように考える: 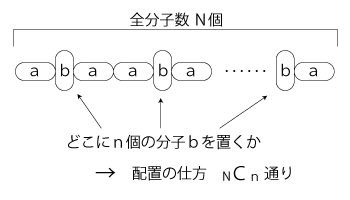
いま,N個の分子からなる鎖状高分子化合物があったとき,この系の温度を変化させていくと何が起こるか。 系のいまの熱エネルギーをHとする。 b型分子の数をnとすると,
系の状態数Wは,N個の分子のうちどのn個の分子をb型にするかの場合の数:
エントロピー S は,
= N log N ー n log n ー (Nーn) log (Nーn)
= ー n log n + n log N ー (Nーn) log (Nーn) + (Nーn) log N = (ーn) ( log n ー log N ) ー (Nーn) ( log (Nーn) ー log N ) = ーn log n/N ー (Nーn) log (1ーn/N ) = N ( ーn/N log n/N ー (1ーn/N) log (1ーn/N ) = ーN ( p log p + (1ーp) log (1ーp ) )
0 ≤ p ≤ 1 に留意して,S = ーN ( p log p + (1ーp) log (1ーp ) ) のグラフを描く。 つぎが y=x log x + (1ーx) log (1ーx) のグラフであった ( 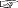 エントロピー関数): エントロピー関数):
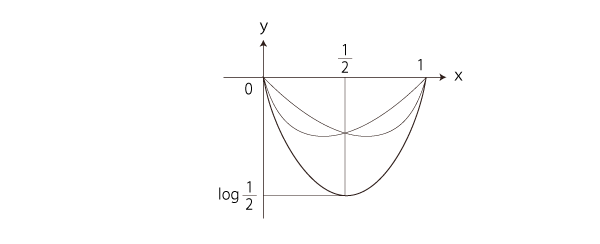
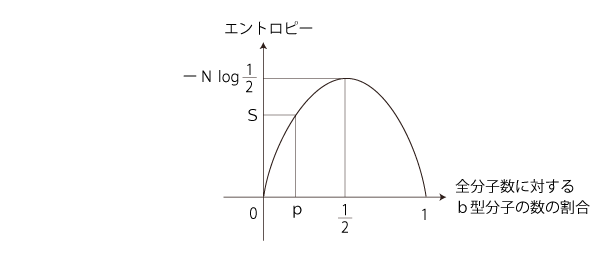
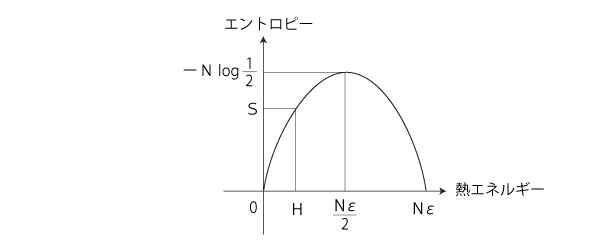
「エントロピー増大則」を満たすのは,つぎの部分: 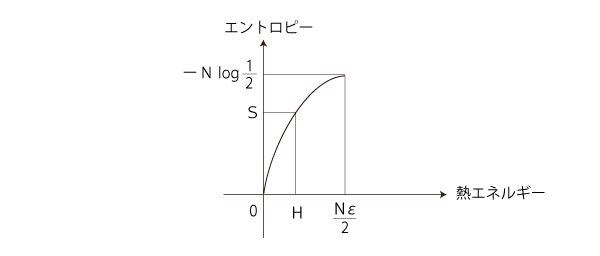
温度β = dS/dH をグラフに記入するならば: 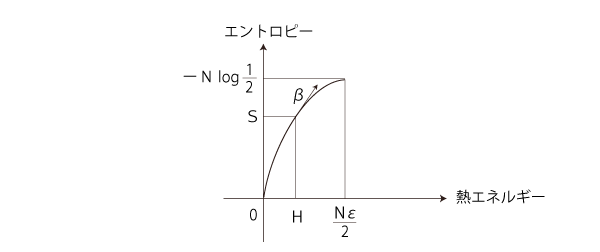
また,このグラフから,温度βと熱エネルギーHの対応グラフも読み取れる:
βの増加と Hの減少が対応 β= ∞ と H = 0 が対応 なお,βとHの対応式は,H = Nε/ (eεβ +1 )
= dS/dp × dp/dH = d(ーN (p log p + (1ーp) log (1ーp) )/dp × d(H/(Nε))/dH = ーN ( ( log p+ p・1/p ) + ( (ー1) log (1ーp) + (1ーp)・(ー1/ (1ーp))) × 1/(Nε) ) = ーN ( log p+ 1 ー log (1ーp) ー1 ) × 1/(Nε) ) = ー log p/(1ーp) /ε ⇐⇒ p/(1ーp) = eーεβ ⇐⇒ p = (1ーp) eーεβ ⇐⇒ p (1+ eーεβ ) = eーεβ ⇐⇒ p = eーεβ / (1+ eーεβ ) = 1 / (eεβ +1 ) ⇐⇒ H = Nε/ (eεβ +1 ) |